Wie Immunzellen sich wirklich fortbewegen – Projekt AGELESS wird langfristige Datenreihen für den Ozean der Zukunft nutzen
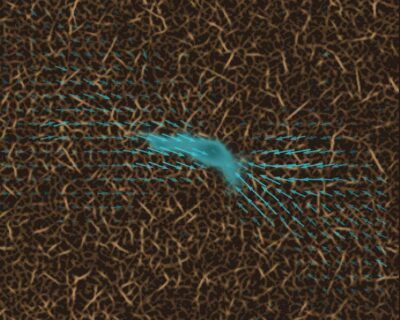
Um von A nach B zu kommen, passen Immunzellen nicht nur ihre Form an. Gelegentlich und für kurze Zeit haften sie sich auch an ihrer Umgebung an und üben auf diese Kräfte aus, um sich nach vorn zu ziehen. „Diese kontraktilen Phasen helfen den Immunzellen, sich durch besonders enge Poren zu bewegen“, erklärt Prof. Dr. Ben Fabry, Inhaber des FAU-Lehrstuhls für Biophysik und Mitautor der Studie mit dem Titel „Dynamic traction force measurements of migrating immune cells in 3D biopolymer matrices“. „Immunzellen sind viel schneller und bedeutend kleiner als die meisten anderen Zellen im Bindegewebe. Deshalb konnten wir solche Zugkräfte bei Immunzellen bisher nicht messen. Unsere Entdeckung wurde erst durch eine neue, deutlich schnellere und empfindlichere Methode ermöglicht, die wir in den vergangenen Jahren in Erlangen entwickelt und immer weiter verbessert haben.“
Forschung an der Schnittstelle Mechanobiologie
Bei der neuen Messmethode handelt es sich um die 3D-Traction-Force-Microscopy, also eine dreidimensionale Untersuchung von Zugkraft und ihrer Auswirkung auf Gewebe. Mit dieser Methode können selbst die winzigen Kräfte von Nervenzellen bei ihrem Wachstum gemessen werden, aber auch die Kräfte von größeren Zellverbänden, etwa von Tumoren.
Die Zusammensetzung des Teams aus Forschenden der Immunologie, Physik, Mechanik und der Neurowissenschaften zeigt, dass die durch die 3D-Traction-Force-Microscopy gewonnenen Erkenntnisse nicht einer isolierten Disziplin dienen, sondern zukunftsweisend für Wissenschaften sind, die sich an der Schnittstelle der Mechanobiologie treffen.
Prof. Fabry betont: „Unsere Entdeckung, dass Immunzellen für kurze Zeit hohe Kontraktionskräfte erzeugen können, ist nur ein Beispiel dafür, wie diese neue Methode zu grundlegenden Entdeckungen führen wird. Wir konnten in unserer Studie beispielsweise auch zeigen, dass wachsende Nervenzellen – hier insbesondere der sogenannte Wachstumskegel – ebenfalls Kontraktionskräfte auf die Umgebung übertragen. Das könnte für die Bildung von Nervenbahnen von fundamentaler Bedeutung sein, besonders im sich entwickelnden Gehirn.“
Weitere Studien notwendig
Die Forschungsergebnisse erlauben noch keine Vorhersagen über zukünftige Anwendungen. Fabry sowie seinen Kolleginnen und Kollegen können sich aber vorstellen, dass das Wissen über die Kontraktionskräfte von Immun-, Nerven- oder Krebszellen etwa bei der Entwicklung von Medikamenten genutzt werden könnte, um gewünschte Heilprozesse gezielt zu fördern oder Krankheitsverläufe zu unterdrücken.
In der Zwischenzeit arbeiten die Wissenschaftlerinnen und Wissenschaftler der FAU an einer weiteren von der Deutschen Forschungsgemeinschaft (DFG) geförderten Studie, um die genauen molekularen Mechanismen der kraftvermittelten Migration von Immunzellen zu untersuchen.
Weitere Informationen
Link zur Publikation: DOI: 10.1038/s41567-024-02632-8
Kontakt
Prof. Dr. Ben Fabry
Lehrstuhl für Biophysik
Tel.: 09131/85-25610
ben.fabry@fau.de